



Kontakt
Die Uniklinik Köln steht rund um die Uhr für die Versorgung von Notfallpatienten zur Verfügung.
In lebensbedrohlichen Situationen / Notruf
Ärztlicher Notdienst
Notfallambulanz für Augenheilkunde
Anfahrtsadresse für Navigationsgeräte
Kerpener Straße
62
50937
Köln
Augenklinik Gebäude 34
Zufahrt über Gleueler Straße
Maligne Tumoren am und im Auge können zur Erblindung führen und stellen gegebenenfalls eine lebensbedrohliche Erkrankung dar. Das uveale Melanom, welches in der Aderhaut, dem Ziliarkörper oder der Iris vorkommen kann, ist dabei das häufigste intraokuläre Primärmalignom im Erwachsenenalter. Uveale Melanome haben eine Neigung zur hämatogenen Metastasierung, vornehmlich in die Leber. Karzinome und Melanome der Bindehaut stellen dagegen die häufigsten malignen Tumoren der Augenoberfläche dar. Diese neigen eher zu einer Metastasierung in die loco-regionalen Lymphknoten.
Für Patienten mit einer metastasierenden Tumorerkrankung des Auges gibt es derzeit keine erfolgreichen Therapieoptionen. Denn trotz erfolgreicher Behandlung des Primärtumors sterben mittelfristig bis zu 50 % dieser Patienten an Fernmetastasen. Daher ist ein besseres Verständnis der grundlegenden molekularen und zellulären Mechanismen, die zu einer Metastasierung führen, erforderlich, um neue und wirksame Therapiestrategien entwickeln zu können.
Unsere experimentelle Arbeitsgruppe fokussiert sich daher auf die Untersuchung dieser molekularen und zellulären Metastasierungsmechanismen. Auf Basis unserer Erkenntnisse werden dann neue Therapieoptionen entwickelt. Diese sollen die Metastasierung verhindern und dadurch das Überleben der Patienten signifikant verlängern.
Das komplexe, dynamische und heterogene TME besteht aus zellulären und nicht-zellulären Komponenten. Hierzu zählen unter anderem Stromazellen, wie die Blut- und Lymphendothelzellen und Immunzellen sowie die extrazelluläre Matrix und sekretierte Moleküle, wie Wachstumsfaktoren. Alle Komponenten des Tumors, einschließlich des TMEs können miteinander interagieren und das Tumorwachstum sowie die Metastasierung beeinflussen. Bei den bisher entwickelten Therapiekonzepten wurden diese Interaktionen häufig außeracht gelassen. Aus diesem Grund ist die Untersuchung des TME sowie dessen Interaktionen mit den Tumorzellen ein Schwerpunkt in unserer Arbeitsgruppe.
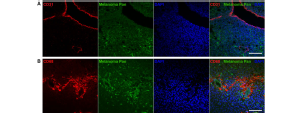
Die Ausbildung neuer aus bereits bestehenden Blut- und Lymphgefäßen (Häm- und Lymphangiogenese) gilt als ein entscheidender Risikofaktor für die Metastasierung und Mortalität bei verschiedenen nicht-okulären Neoplasien. Unsere Arbeitsgruppe konnte erstmals das Vorhandensein einer tumor-assoziierten Lymphangiogenese auch bei malignen Tumoren der Augenoberfläche nachweisen. Diese tumor-induzierten Lymphgefäße korrelieren signifikant mit der lymphogenen Metastasierung, dem Rezidivrisiko und der Mortalität. Daher ist ein Schwerpunkt unserer Arbeitsgruppe die Etablierung neuer nicht-invasiver klinischer Risikoscores wie auch neuer adjuvanter anti(lymph)angiogener Therapien in der klinischen Versorgung von malignen Tumoren des Auges, um das Rezidiv-, Metastasierungs- und Mortalitätsrisiko dieser Patienten zu verringern.
Immunsystem ist essentieller Bestandteil des TMEs, welches die maligne Transformation, das Tumorwachstum, die Metastasierung sowie das Ansprechen auf Chemotherapeutika beeinflusst. Im Mittelpunkt dieser Vorgänge stehen neben zytotoxische T-Zellen insbesondere tumorassoziierte Makrophagen (TAM). Aus diesem Grund ist die Untersuchung von adjuvanten Therapien in Form von immunmodulierenden Therapeutika ein weiterer Schwerpunkt unsere Arbeitsgruppe. Unser Ziel ist es, das Tumorwachstum, die Rezidivraten und die Metastasierung bei Patienten mit okulären Karzinomen und Melanomen zu reduzieren und so das Überleben dieser Patienten zu verbessern.

Proteine sind Schlüsselakteure in allen zellulären Prozessen. Sie fungieren unter anderem als Signaltransduktionsmoleküle und vermitteln die zelluläre Kommunikation zwischen verschiedenen Zellen. In einer Vielzahl von Erkrankungen unter anderem auch bei Tumorerkrankungen können pathologische Veränderungen in der Expression, Sekretion und der Signaltransduktion von Proteinen nachgewiesen werden. Dies stellt die Grundlage dar, um die molekularen und zellulären Tumor- und Metastasierungsmechanismen von okulären Karzinomen und Melanomen zu entschlüsseln. Daher ist ein weiterer Schwerpunkt unserer Arbeitsgruppe die Untersuchung und Identifizierung von neuen Proteinen, welche bei der Tumorentstehung, dem Tumorwachstum und der Metastasierung von okulären Karzinomen und Melanomen beteiligt sind.
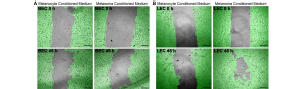
Die neu Identifizierten Targets werden vorerst in vitro auf ihren Einfluss auf die Tumorzellen selbst und die verschiedenen Zellen des TMEs sowie die Kombination untersucht. Hierzu führen wir ein breites Spektrum an funktionellen Assays durch, um Beispielsweise den Einfluss auf die Hem- und Lymphangiogenese, welche im Mittelpunkt der Metastasierung steht zu untersuchen. Anschließend werden vielversprechende neue therapeutische Targets in vivo auf deren reduzieren Einfluss auf die Tumorentstehung, das Tumorwachstum und der Metastasierung hin analysiert. Dies stellt die Basis für die Entwicklung neuer Therapiekonzepte für Patienten mit okulären Karzinomen und Melanomen dar. Daher ist die Testung ebenso ein wichtiger Schwerpunkt unserer Arbeitsgruppe.
Besonders Patienten mit einem uvealen Melanom, welche eine Monosomie 3 aufweisen, haben eine dramatisch schlechte Prognose. Die meisten Patienten entwickeln Metastasen in der Leber und weisen ein deutlich erhöhtes Mortalitätsrisiko auf. Ein neuerer und sehr vielversprechender Ansatz ist die personalisierten „Tumorimpfung“ für Hochrisikopatienten (Monosomie 3) mit einem uvealen Melanom. Hierzu werden die immunregulatorischen dendritischen Zellen (DCs) ex vivo angezogen und mit spezifischen Tumorantigenen beladen. Diese modulierten DCs werden dem Patienten wieder verabreicht und führen zur Aktivierung von zytotoxischen T-Zellen, wodurch eine Immunantwort gegen die geimpften Tumorantigene induziert wird. So wird das eigene Immunsystem genutzt, um die Tumorzellen zu eliminieren.
Die Ophthalmo-Onkologie findet sich als „Emerging field“ eingebunden im Centrum für Integrierte Onkologie Aachen Bonn Köln Düsseldorf (CIO), das durch die Deutsche Krebshilfe gefördert wird. Darüber hinaus bestehen enge Kooperationen mit dem Cologne Excellence Cluster on Cellular Stress Responses in Aging-Associated Diseases (CECAD) und dem Zentrum für Molekulare Medizin Köln (ZMMK).
Rokohl AC, Koch KR, Mor JM, Loreck N, Schlaak M, Mauch C, Bechrakis NE, Mohi A, Kakkassery V, Heindl LM. Personalisierte Medizin in der Behandlung von periokulären Tumoren: Zielgerichtete Therapien und der Einsatz von Immun-Checkpoint-Inhibitoren [Personalized medicine in the treatment of periocular tumors: Targeted treatment and use of immune checkpoint inhibitors]. Ophthalmologe. 2020 Jun;117(6):521-527. German. doi: 10.1007/s00347-019-01034-z. PMID: 31938823.
Heindl LM. Periokuläres Basalzellkarzinom [Periocular basal cell carcinoma]. Ophthalmologe. 2020 Feb;117(2):93-94. German. doi: 10.1007/s00347-019-01026-z. PMID: 32034522.
Kakkassery V, Heindl LM. Standardvorgehensweise bei Basalzellkarzinom am Auge [Standard operation procedure in periorbital basal cell carcinoma]. Ophthalmologe. 2020 Feb;117(2):124. German. doi: 10.1007/s00347-019-01019-y. PMID: 31820083.
Schuler-Thurner B, Bartz-Schmidt KU, Bornfeld N, Cursiefen C, Fuisting B, Grisanti S, Heindl LM, Holbach L, Keserü M, Knorr H, Koch K, Kruse F, Meiller R, Metz C, Meyer-ter-Vehn T, Much M, Reinsberg M, Schliep S, Seitz B, Schuler G, Süsskind D, Viestenz A, Wagenfeld L, Zeschnigk M. Immuntherapie beim Aderhautmelanom: Vakzination gegen Krebs. Multizentrische adjuvante Phase-III-Impfstudie mit Tumor-RNA-beladenen dendritischen Zellen bei neu diagnostizierten, großen Uveamelanomen [Immunotherapy of uveal melanoma: vaccination against cancer. Multicenter adjuvant phase 3 vaccination study using dendritic cells laden with tumor RNA for large newly diagnosed uveal melanoma]. Ophthalmologe. 2015 Dec;112(12):1017-21. German. doi: 10.1007/s00347-015-0162-z. PMID: 26602097.
Schlereth SL, Iden S, Mescher M, Ksander BR, Bosch JJ, Cursiefen C, Heindl LM. A Novel Model of Metastatic Conjunctival Melanoma in Immune-Competent Mice. Invest Ophthalmol Vis Sci. 2015 Sep;56(10):5965-73. doi: 10.1167/iovs.15-17290. PMID: 26377082.
Refaian N, Schlereth SL, Koch KR, Notara M, Hos D, Mescher M, Iden S, Bosch JJ, Jager MJ, Cursiefen C, Heindl LM. Comparing the Hem- and Lymphangiogenic Profile of Conjunctival and Uveal Melanoma Cell Lines. Invest Ophthalmol Vis Sci. 2015 Aug;56(9):5691-7. doi: 10.1167/iovs.15-16829. PMID: 26313304.
Schlereth SL, Refaian N, Iden S, Cursiefen C, Heindl LM. Impact of the prolymphangiogenic crosstalk in the tumor microenvironment on lymphatic cancer metastasis. Biomed Res Int. 2014;2014:639058. doi: 10.1155/2014/639058. Epub 2014 Sep 1. PMID: 25254213; PMCID: PMC4165560.
Koch KR, Refaian N, Hos D, Schlereth SL, Bosch JJ, Cursiefen C, Heindl LM. Autocrine impact of VEGF-A on uveal melanoma cells. Invest Ophthalmol Vis Sci. 2014 Apr 25;55(4):2697-704. doi: 10.1167/iovs.13-13254. PMID: 24677103.
Prof. Bruce Ksander, Schepens Eye Research Institute, Massachusetts Eye and Ear Infirmary and Department of Ophthalmology, Harvard Medical School, Boston, USA
Dr. Margarete Karg, Schepens Eye Research Institute, Massachusetts Eye and Ear Infirmary and Department of Ophthalmology, Harvard Medical School, Boston, USA
Dr. Jacobus J. Bosch, CRC Core Facility, Zentrum für frühe klinische Studien und Arzneiforschung, Medizinische Hochschule Hannover, Deutschland
Prof. Renbing Jia, Department of Ophthalmology, Ninth People's Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai, China
Dr. Christian Frese, Proteomics Research Platform, Max Planck Unit for the Science of Pathogens, Berlin, Deutschland
Dr. Yue Zhao & Dr. Hakan Alakus, Chirurgische Forschungslabor für Molekulare Onkologie, Klinik und Poliklinik für Allgemein-, Viszeral-, Tumor- und Transplantationschirurgie, Uniklinik Köln, Deutschland
Prof. Dr. Falk Schrödl, Institut für Anatomie und Zellbiologie, Paracelsus Universität Salzburg, Österreich
Universitätsklinikum Köln
Verfügungsgebäude Forschung (Gebäude 74, Lageplan)
AG Heindl (Ophthalmo-Onkologie)
1. OG, Raum 1.021
Weyertal 115c
50931 Köln