- Startseite
- Forschung
- AG Neuroimmunologie & Ophthalmologie
Interdisziplinäre AG Neuroimmunologie und Ophthalmologie
Viele neurologische, insbesondere neuroimmunologische Erkrankungen betreffen auch das Auge. Sehstörungen sowie morphologische Veränderungen am und im Auge können zudem auch das erste Anzeichen für diese teilweise sehr gravierenden (System-)Erkrankungen sein.
Insbesondere ein (akuter) Visusverlust im Rahmen einer solchen Erkrankung stellt einen medizinischen Notfall dar. Der Therapieerfolg hängt entscheidend von der richtigen Diagnose und der (zeitnahen) Therapieeinleitung ab. Häufig erfordern die Diagnosestellung und Behandlung eine enge interdisziplinäre Zusammenarbeit zwischen der Neurologie und der Ophthalmologie.
Übergeordnete Zielsetzung unserer AG ist daher die Verbesserung der interdisziplinären Versorgung von Patienten mit neurovaskulären und neuroimmunologischen Erkrankungen. Wir beschäftigen uns insbesondere mit Veränderungen der retinalen Ganglienzellschicht und der kornealen Innervation sowie mit okulären immunologischen und proinflammatorischen Prozessen bei diesen Erkrankungen unter Nutzung modernster Technik wie künstlicher Intelligenz.
Wissenschaftlicher Fokus
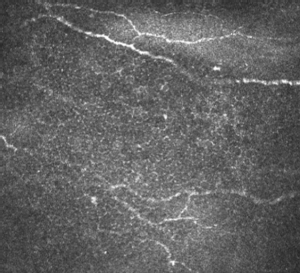
Konfokale Mikroskopie zur nichtinvasiven, in-vivo Diagnostik der Hornhautinnervation bei neurologischen Erkrankungen
Mithilfe der kornealen in-vivo Konfokalmikroskopie kann man nichtinvasiv und reproduzierbar den subbasalen Nervenplexus der Hornhaut analysieren. Diese kleinkalibrigen Nervenfasern entstammen dem N. ophthalmicus als Ast des N. trigeminus und lassen sich Fasern mit polymodalen Rezeptoren für nozizeptive, mechanische und Kältereize zuordnen. Mithilfe quantitativer Morphometrie lassen sich die wichtigsten Parameter der kornealen Konfokalmikroskopie, wie Nervenfaserlänge, Nervenfaserdichte und Anzahl der Verästelungspunkte der Nerven bestimmen und so Pathologien der Hornhautinnervation diagnostizieren. Daneben lassen sich auch bestimmte Entzündungszellen, die sogenannten dendritischen Zellen, in der Kornea quantifizieren.
Erkrankungen der Hornhaut selbst, wie beispielsweise die Fuchs’sche Hornhautendotheldystrophie können zu einer in der kornealen Konfokalmikroskopie messbaren Reduktion der Hornhautinnervation führen. Aber auch Allgemeinerkrankungen, wie der Diabetes mellitus können Alterationen des subbasalen Nervenplexus der Hornhaut hervorrufen, noch bevor es zu klinisch manifesten Polyneuropathien kommt. So konnte unsere interdisziplinäre Kölner AG erstmalig eine Affektion der Hornhautnerven wie auch der kornealen Dendritischen Zellen im Rahmen autoimmun vermittelter Polyneuropathien, wie der chronischen inflammatorischen demyelinisierenden Polyradikuloneuropathie (CIDP) und der Small-Fiber Neuropathie (SFN) diagnostizieren.
Aktuell untersuchen wir, ob die korneale Konfokalmikroskopie als Surrogatmarker zur Diagnostik einer zytostatika-induzierten Polyneuropathie Verwendung finden kann, indem wir die Hornhautuntersuchungen mit der Neurosonographie der Nerven N. medianus, N. ulnaris, N. radialis, N. fibularis, N. tibialis und N. suralis bei Patienten mit Chemotherapie induzierter Polyneuropathie unter der Therapie mit Vincristin, Paclitaxel und Oxaliplacin korrelieren.
Mittelfristiges Ziel ist es, moderne Techniken aus dem Bereich der Mustererkennung und der künstlichen Intelligenz zu nutzen, um die Auswertung der kornealen Konfokalmikroskopie zu automatisieren und damit die Versorgung der Patientinnen und Patienten nachhaltig zu verbessern.
Der Sehnervenkopf ist der ophthalmoskopisch sichtbare vordere Anteil des Sehnerven, in dem die Axone der retinalen Ganglienzellen die Sehinformation in Richtung der zentralen Verarbeitungsorte fortleiten. Dieser Ort ist durch die Bündelung der Nervenfasern und das relative Fehlen anderer Strukturen besonders geeignet, um den Zustand der Ganglienzellaxone zu untersuchen.
Mit der „Spectral-Domain“ optischen Kohärenztomographie (SD-OCT), aber auch der „Swept-Source“ (SS-OCT) und der OCT-Angiographie (OCT-A) stehen durch den Einsatz von Licht niedriger Kohärenzlänge und Interferometrie neue Technologien zur hochauflösenden Darstellung von Netzhautstrukturen zur Verfügung.
Die am häufigsten verwendeten Parameter sind die peripapillär und makulär gemessene retinale Nervenfaserschichtdicke, die auf dem Ende der Bruch’schen Membran beruhende minimale Randsaumweite der Bruch’schen Membranöffnung, die zweidimensionale minimale Randsaumfläche der Bruch’schen Membranöffnung wie auch die Gefäßdichte der retinalen Mikrovaskularisation.
Die retinalen Ganglienzellaxone sowie die retinalen Gefäße können nicht nur im Rahmen ophthalmologischer Erkrankungen, wie dem Grünen Star (Glaukom) geschädigt werden, sondern auch im Rahmen von neurodegenerativen, neuroinflammatorischen und anderen neurologischen Erkrankungen. Deshalb nutzen wir die hochauflösende OCT und OCT-A insbesondere zur nichtinvasiven, in-vivo Diagnostik der retinalen Ganglienzellaxone sowie der retinalen Gefäße bei häufigen neurologischen Erkrankungen wie Multiple Sklerose, Alzheimer und Parkinson, aber auch selteneren neurologischen Erkrankungen wie dem Guillain-Barré-Syndrom, dem Susac-Syndrom oder Erkrankungen aus dem Neuromyelitis-Optica-Spektrum.
Aktuell untersuchen wir wissenschaftlich, ob moderne Methoden aus dem Bereich der artifiziellen Intelligenz (AI) inklusive Deep Learning dazu genutzt werden können, um Diagnostikmarker zur (Früh-) Erkennung sowie zur Verlaufsbeurteilung neurologischer, neuroinflammatorischer und neuroimmunologischer Erkrankungen zu identifizieren. Übergeordnete Zielsetzung ist die Versorgung dieser Patientinnen und Patienten weiter zu verbessern.
Tränenfilmproben (Tränenflüssigkeit) werden mittels Schirmer-Teststreifen gewonnen. Die Tränenflüssigkeitsmenge, die in dem Schirmer-Teststreifen vorhanden ist, kann mit einer im Vorfeld entwickelten Standardfunktion berechnet werden. Die Tränenflüssigkeit wird dann aus dem Schirmer-Teststreifen in einem eigens entwickelten Verfahren eluiert. Der Filterpapierstreifen wird anschließend in ein Behältnis gegeben und bei -80° C eingefroren. Die gesammelten Proben werden mit biochemischen (z. B. Mikro-RNA-Analyse) und biophysikalischen Verfahren (z. B. Massenspektrometrie) in Zusammenarbeit mit dem CECAD untersucht.
Es ist bekannt, dass Uveitis (vor allem die intermediäre Form) und Multiple Sklerose (MS) häufig konkomitierend auftreten. Die Prävalenz einer Uveitis bei MS-PatientInnen reicht bis zu 20%, und bis zu 14 % aller PatientInnen mit Uveitis haben auch eine MS. MS und Uveitis sind beide mit der Expression des HLA-DRB1*15:01-Haplotyps assoziiert, was auf eine genetische Prädisposition schließen lässt.
Auch wird postuliert, dass Antigene, die sowohl in der Uvea als auch im Zentralen Nervensystem (ZNS) koexprimiert werden (z.B. S100beta, Retinal soluble antigen (S-Ag, arrestin), für die Komorbidität verantwortlich sind. Tiermodelle beider Erkrankungen beruhen auf der aktiven oder passiven Immunisierung mit relevanten Antigenen. In einem gemeinsamen Projekt möchten wir daher untersuchen, welche Faktoren dafür verantwortlich, sind, dass Inflammation lokal begrenzt bleibt, oder aber sich auf Uvea und ZNS ausbreitet. Kandidaten, die hierfür verantwortlich sein könnten, sind, CD25+ regulatorische T-Zellen oder auch antiinflammatorische Zytokine, sowie Metalloproteinasen, die die Blut-Hirn-Schranke bzw. Blut-Retina-Schranke schädigen können.
Weitere Informationen
- Bucher F, Adler W, Lehmann HC, Hos D, Steven P, Cursiefen C, Heindl LM. Corneal nerve alterations in different stages of Fuchs‘ endothelial corneal dystrophy: an in vivo confocal microscopy study. Graefes Arch Clin Exp Ophthalmol 2014; 252: 1119-26.
- Schneider C, Bucher F, Cursiefen C, Fink GR, Heindl LM, Lehmann HC. Corneal confocal microscopy detects small fiber damage in chronic inflammatory demyelinating polyneuropathy (CIDP). J Peripher Nerv Syst 2014; 19: 322-7.
- Bucher F, Schneider C, Blau T, Cursiefen C, Fink GR, Lehmann HC, Heindl LM. Small-fiber neuropathy is associated with corneal nerve and dendritic cell alterations: an in vivo confocal microscopy study. Cornea 2015; 34: 1114-9.
- Bucher F, Fricke J, Cursiefen C, Heindl LM. Trigeminal involvement in parry-romberg syndrome: an in vivo confocal microscopy study of the cornea. Cornea 2015; 34: e10-1.
- Bucher F, Hos D, Matthaei M, Steven P, Cursiefen C, Heindl LM. Corneal nerve alterations after Descemet membrane endothelial keratoplasty: an in vivo confocal microscopy study. Cornea 2014; 33: 1134-9.
- Enders P, Schaub F, Hermann MM, Cursiefen C, Heindl LM. Neuroretinal rim in non-glaucomatous large optic nerve heads: a comparison of confocal scanning laser tomography and spectral domain optical coherence tomography. Br J Ophthalmol 2017; 101: 138-142.
- Enders P, Adler W, Schaub F, Hermann MM, Dietlein T, Cursiefen C, Heindl LM. Novel Bruch’s membrane opening minimum rim area equalizes disc size dependency and offers high diagnostic power for glaucoma. Invest Ophthalmol Vis Sci 2016; 57: 6596-6603.
- Enders P, Bremen A, Schaub F, Hermann MM, Diestelhorst M, Dietlein T, Cursiefen C, Heindl LM. Intraday repeatability of Bruch’s membrane opening-based neuroretinal rim measurements. Invest Ophthalmol Vis Sci 2017; 58: 5195-5200.
- Enders P, Adler W, Schaub F, Hermann MM, Diestelhorst M, Dietlein T, Cursiefen C, Heindl LM. Optimization strategies for Bruch’s membrane opening minimum rim area calculation: sequential versus simultaneous minimization. Sci Rep 2017; 7: 13874.
- Caramoy A, Heindl LM. Variability of choroidal and retinal thicknesses in healthy eyes using swept-source optical coherence tomography – implications for designing clinical trials. Clin Ophthalmol 2017; 11: 1835-1839.
- Heindl LM, Adler W, El-Malahi O, Schaub F, Hermann MM, Dietlein TS, Cursiefen C, Enders P. The optimal diameter for circumpapillary retinal nerve fiber layer thickness measurement by SD-OCT in glaucoma. J Glaucoma 2018; 27: 1086-1093.
- Enders P, Longo V, Adler W, Horstmann J, Schaub F, Dietlein T, Cursiefen C, Heindl LM. Analysis of peripapillary vessel density and Bruch’s membrane opening-based neuroretinal rim parameters in glaucoma using OCT and OCT-angiography. Eye 2020; 34: 1086-1093.
- Grajewski RS, Boelke AC, Adler W, Meyer S, Caramoy A, Kirchhof B, Cursiefen C, Heindl LM. Spectral-domain optical coherence tomography findings of the macula in 500 consecutive patients with uveitis. Eye 2016; 30: 1415-1423.
- Grajewski RS, Heindl LM. Macular thickening of uveitic eyes in the absence of macular oedema and epiretinal membranes. Acta Ophthalmol 2017; 95: e77-e78.
- Köln Fortune, Medizinische Fakultät, Universität zu Köln
- Cologne Clinician Scientist Programm (CCSP), Medizinische Fakultät, Universität zu Köln
- Deutsche Forschungsgemeinschaft (DFG)
- Dr. Jörg Philipps (Neurologie, Minden)
- Prof. Dr. P. D. Schellinger (Neurologie, Minden)
- Priv.-Doz. Dr. Franziska Bucher (Novartis, Nürnberg)
Das Team
Dr. Christian Schneider (Neurologie)
Dr. Martin Svacina (Neurologie)
Dr. Felix Kohle (Neurologie)
Dr. Alina Sprenger-Svavina (Neurologie)
Dr. Julia Fricke (Ophthalmologie)
Priv.-Doz. Dr. Andrea Hedergott (Ophthalmologie)
Dr. Alexander C. Rokohl (Ophthalmologie)
Prof. Dr. Rafael Grajewski (Ophthalmologie)
Priv.-Doz. Dr. Philip Enders (Ophthalmologie)
Vadim Makhmutov (Ophthalmologie)


![[Bildbeschreibung]](https://webstatic.uk-koeln.de/im/headerimage/236633/standard/820/image-236633.png)
![[Bildbeschreibung]](https://webstatic.uk-koeln.de/im/headerimage/236630/standard/820/image-236630.png)
![[Bildbeschreibung]](https://webstatic.uk-koeln.de/im/headerimage/236631/standard/820/image-236631.png)
![[Bildbeschreibung]](https://webstatic.uk-koeln.de/im/gallery/236633/image/thumb/image-236633.png)
![[Bildbeschreibung]](https://webstatic.uk-koeln.de/im/gallery/236630/image/thumb/image-236630.png)
![[Bildbeschreibung]](https://webstatic.uk-koeln.de/im/gallery/236631/image/thumb/image-236631.png)